Ang isang mahalagang seksyon ng thermodynamics ay ang pag-aaral ng mga pagbabagong-anyo sa pagitan ng iba't ibang yugto ng isang substansiya, dahil ang mga prosesong ito ay nagaganap sa pagsasagawa at may pangunahing kahalagahan para sa paghula ng pag-uugali ng isang sistema sa ilalim ng ilang partikular na kundisyon. Ang mga pagbabagong ito ay tinatawag na mga phase transition, kung saan nakatuon ang artikulo.
Ang konsepto ng isang bahagi at isang bahagi ng system

Bago magpatuloy sa pagsasaalang-alang ng mga phase transition sa physics, kinakailangang tukuyin ang konsepto ng phase mismo. Tulad ng nalalaman mula sa kurso ng pangkalahatang pisika, mayroong tatlong estado ng bagay: gas, solid at likido. Sa isang espesyal na seksyon ng agham - sa thermodynamics - ang mga batas ay binuo para sa mga yugto ng bagay, at hindi para sa kanilang mga estado ng pagsasama-sama. Ang isang bahagi ay nauunawaan bilang isang tiyak na dami ng bagay na may homogenous na istraktura, na nailalarawan sa pamamagitan ng mga partikular na katangiang pisikal at kemikal at pinaghihiwalay mula sa iba pang bagay sa pamamagitan ng mga hangganan, na tinatawag na interphase.
Kaya, ang konsepto ng "phase" ay nagdadala ng mas praktikal na makabuluhang impormasyon tungkol sa mga katangianbagay kaysa sa estado ng pagsasama-sama nito. Halimbawa, ang solid state ng isang metal gaya ng bakal ay maaaring nasa mga sumusunod na yugto: low-temperature magnetic body-centered cubic (BCC), low-temperature non-magnetic bcc, face-centered cubic (fcc), at high- temperatura na hindi magnetic bcc.
Bilang karagdagan sa konsepto ng "phase", ginagamit din ng mga batas ng thermodynamics ang terminong "mga sangkap", na nangangahulugang ang bilang ng mga elemento ng kemikal na bumubuo sa isang partikular na sistema. Nangangahulugan ito na ang bahagi ay maaaring alinman sa monocomponent (1 elemento ng kemikal) o multicomponent (maraming elemento ng kemikal).
Gibbs' theorem at equilibrium sa pagitan ng mga phase ng system

Upang maunawaan ang mga phase transition, kailangang malaman ang mga kondisyon ng equilibrium sa pagitan ng mga ito. Ang mga kundisyong ito ay maaaring makuha sa matematika sa pamamagitan ng paglutas ng sistema ng mga equation ng Gibbs para sa bawat isa sa kanila, sa pag-aakalang naabot ang estado ng ekwilibriyo kapag ang kabuuang enerhiya ng Gibbs ng system na nakahiwalay sa panlabas na impluwensya ay tumigil sa pagbabago.
Bilang resulta ng paglutas sa ipinahiwatig na sistema ng mga equation, nakukuha ang mga kundisyon para sa pagkakaroon ng ekwilibriyo sa pagitan ng ilang mga yugto: ang isang nakahiwalay na sistema ay titigil sa pag-evolve lamang kapag ang mga presyon, mga potensyal na kemikal ng bawat bahagi at mga temperatura sa lahat ng mga yugto ay pantay sa isa't isa.
Gibbs phase rule para sa equilibrium

Ang isang sistema na binubuo ng ilang mga yugto at mga bahagi ay maaaring nasa equilibrium hindi lamangsa ilalim ng ilang mga kundisyon, halimbawa, sa isang tiyak na temperatura at presyon. Ang ilan sa mga variable sa Gibbs theorem para sa equilibrium ay maaaring baguhin habang pinapanatili ang parehong bilang ng mga phase at ang bilang ng mga bahagi na nasa ekwilibriyong ito. Ang bilang ng mga variable na maaaring baguhin nang hindi nakakagambala sa equilibrium sa system ay tinatawag na bilang ng mga kalayaan ng system na ito.
Ang bilang ng mga kalayaan l ng isang system na binubuo ng mga f phase at k na bahagi ay natatanging tinutukoy mula sa Gibbs phase rule. Ang panuntunang ito ay nakasulat sa matematika tulad ng sumusunod: l + f=k + 2. Paano gamitin ang panuntunang ito? Napakasimple. Halimbawa, alam na ang sistema ay binubuo ng f=3 equilibrium phase. Ano ang pinakamababang bilang ng mga sangkap na maaaring maglaman ng naturang sistema? Maaari mong sagutin ang tanong sa pamamagitan ng pangangatwiran tulad ng sumusunod: sa kaso ng equilibrium, ang pinaka mahigpit na mga kondisyon ay umiiral kapag ito ay natanto lamang sa ilang mga tagapagpahiwatig, iyon ay, ang isang pagbabago sa anumang thermodynamic parameter ay hahantong sa kawalan ng timbang. Nangangahulugan ito na ang bilang ng mga kalayaan l=0. Ang pagpapalit ng mga kilalang halaga ng l at f, nakukuha namin ang k=1, iyon ay, ang isang sistema kung saan ang tatlong mga yugto ay nasa balanse ay maaaring binubuo ng isang bahagi. Ang pangunahing halimbawa ay ang triple point ng tubig, kung saan ang yelo, likidong tubig, at singaw ay umiiral sa equilibrium sa mga partikular na temperatura at pressure.
Pag-uuri ng mga pagbabagong bahagi
Kung sisimulan mong baguhin ang ilang thermodynamic na parameter sa isang sistema sa equilibrium, maaari mong obserbahan kung paano mawawala ang isang phase at lalabas ang isa pa. Ang isang simpleng halimbawa ng prosesong ito ay ang pagtunaw ng yelo kapag pinainit ito.
Dahil ang equation ng Gibbs ay nakadepende lamang sa dalawang variable (presyon at temperatura), at ang phase transition ay nagsasangkot ng pagbabago sa mga variable na ito, pagkatapos ay mathematically ang transition sa pagitan ng mga phase ay maaaring ilarawan sa pamamagitan ng pagkakaiba-iba ng Gibbs energy kaugnay nito mga variable. Ang diskarteng ito ang ginamit ng Austrian physicist na si Paul Ehrenfest noong 1933, nang mag-compile siya ng klasipikasyon ng lahat ng kilalang thermodynamic na proseso na nangyayari na may pagbabago sa phase equilibrium.
Mula sa mga pangunahing kaalaman ng thermodynamics, sumusunod na ang unang derivative ng Gibbs energy na may kinalaman sa temperatura ay katumbas ng pagbabago sa entropy ng system. Ang derivative ng Gibbs energy na may kinalaman sa pressure ay katumbas ng pagbabago sa volume. Kung, kapag ang mga phase sa system ay nagbago, ang entropy o volume ay nasira, ibig sabihin, sila ay biglang nagbabago, pagkatapos ay nagsasalita sila ng isang first-order phase transition.
Dagdag pa, ang pangalawang derivatives ng Gibbs energy na may kinalaman sa temperatura at pressure ay ang heat capacity at ang coefficient ng volumetric expansion, ayon sa pagkakabanggit. Kung ang pagbabago sa pagitan ng mga phase ay sinamahan ng isang discontinuity sa mga halaga ng ipinahiwatig na mga pisikal na dami, kung gayon ang isa ay nagsasalita ng pangalawang-order na phase transition.
Mga halimbawa ng pagbabago sa pagitan ng mga phase

May napakaraming iba't ibang pagbabago sa kalikasan. Sa loob ng balangkas ng klasipikasyong ito, ang mga kapansin-pansing halimbawa ng mga transition ng unang uri ay ang mga proseso ng pagtunaw ng mga metal o ang condensation ng singaw ng tubig mula sa hangin, kapag may tumalon sa dami sa system.
Kung pag-uusapan natin ang tungkol sa mga second-order transition, ang mga kapansin-pansing halimbawa ay ang pagbabago ng bakal mula sa isang magnetic patungo sa isang paramagnetic na estado sa isang temperatura768 ºC o ang pagbabago ng isang metal na conductor sa isang superconducting state sa mga temperaturang malapit sa absolute zero.
Mga equation na naglalarawan ng mga transition ng unang uri
Sa pagsasagawa, kadalasang kailangang malaman kung paano nagbabago ang temperatura, presyon, at hinihigop (pinakawalan) na enerhiya sa isang system kapag nangyayari ang mga pagbabagong bahagi nito. Dalawang mahalagang equation ang ginagamit para sa layuning ito. Nakukuha ang mga ito batay sa kaalaman sa mga pangunahing kaalaman sa thermodynamics:
- formula ni Clapeyron, na nagtatatag ng kaugnayan sa pagitan ng presyon at temperatura sa panahon ng mga pagbabago sa pagitan ng iba't ibang phase.
- Clausius formula na nag-uugnay sa hinihigop (pinakawalan) na enerhiya at temperatura ng system sa panahon ng pagbabago.
Ang paggamit ng parehong mga equation ay hindi lamang sa pagkuha ng quantitative dependence ng mga pisikal na dami, kundi pati na rin sa pagtukoy ng sign ng slope ng equilibrium curves sa mga phase diagram.
Equation para sa paglalarawan ng mga transition ng pangalawang uri

Ang mga phase transition ng 1st at 2nd kind ay inilalarawan ng magkakaibang equation, dahil ang paglalapat ng Clausius at Clausius equation para sa second-order transition ay humahantong sa mathematical uncertainty.
Upang ilarawan ang huli, ginagamit ang mga equation ng Ehrenfest, na nagtatatag ng ugnayan sa pagitan ng mga pagbabago sa presyon at temperatura sa pamamagitan ng kaalaman sa mga pagbabago sa kapasidad ng init at koepisyent ng volumetric expansion sa panahon ng proseso ng pagbabago. Ang mga Ehrenfest equation ay ginagamit upang ilarawan ang conductor-superconductor transition sa kawalan ng magnetic field.
Kahalagahanmga phase diagram
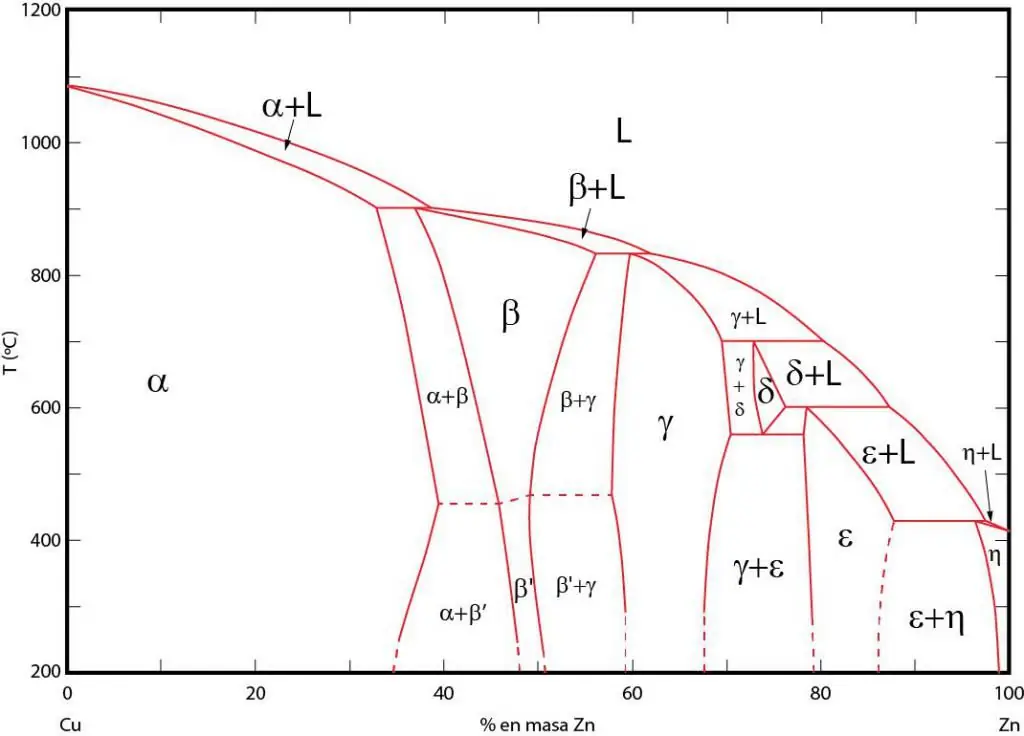
Ang
Phase diagram ay isang graphic na representasyon ng mga lugar kung saan umiiral ang mga kaukulang yugto sa equilibrium. Ang mga lugar na ito ay pinaghihiwalay ng mga linya ng ekwilibriyo sa pagitan ng mga yugto. Kadalasang ginagamit ang P-T (pressure-temperature), T-V (temperatura-volume), at P-V (pressure-volume).
Ang kahalagahan ng mga phase diagram ay nakasalalay sa katotohanan na nagbibigay-daan sa iyo ang mga ito na hulaan kung anong yugto ang magiging bahagi ng system kapag ang mga panlabas na kondisyon ay nagbabago nang naaayon. Ginagamit ang impormasyong ito sa heat treatment ng iba't ibang materyales upang makakuha ng istrukturang may gustong katangian.






