Ideal na gas, ang ideal na gas equation ng estado, ang temperatura at presyon nito, volume… ang listahan ng mga parameter at mga kahulugan na ginamit sa kaukulang seksyon ng physics ay maaaring ipagpatuloy nang medyo mahabang panahon. Ngayon ay pag-uusapan lang natin ang paksang ito.
Ano ang isinasaalang-alang sa molecular physics?

Ang pangunahing bagay na isinasaalang-alang sa seksyong ito ay isang perpektong gas. Ang perpektong equation ng gas ng estado ay nakuha na isinasaalang-alang ang mga normal na kondisyon sa kapaligiran, at pag-uusapan natin ito sa ibang pagkakataon. Ngayon lapitan natin ang "problema" na ito mula sa malayo.
Sabihin nating mayroon tayong ilang masa ng gas. Ang estado nito ay maaaring matukoy gamit ang tatlong mga parameter ng isang thermodynamic na kalikasan. Ang mga ito ay, siyempre, presyon, dami at temperatura. Ang equation ng estado ng system sa kasong ito ay magiging formula para sa relasyon sa pagitan ng kaukulang mga parameter. Mukhang ganito: F (p, V, T)=0.
Dito, sa unang pagkakataon, unti-unti tayong lumalapit sa paglitaw ng isang bagay bilang idealgas. Ito ay tinatawag na isang gas kung saan ang mga pakikipag-ugnayan sa pagitan ng mga molekula ay bale-wala. Sa pangkalahatan, hindi ito umiiral sa kalikasan. Gayunpaman, ang anumang napakabihirang gas ay malapit dito. Ang nitrogen, oxygen at hangin, na nasa ilalim ng normal na mga kondisyon, ay kaunti lamang ang pagkakaiba sa ideal. Upang isulat ang equation ng estado para sa isang perpektong gas, maaari nating gamitin ang pinag-isang batas ng gas. Nakukuha namin ang: pV/T=const.
Kaugnay na Konsepto 1: Batas ni Avogadro
Maaari niyang sabihin sa amin na kung kukuha kami ng parehong bilang ng mga moles ng ganap na anumang random na gas at ilagay ang mga ito sa parehong mga kondisyon, kabilang ang temperatura at presyon, ang mga gas ay sasakupin ang parehong volume. Sa partikular, ang eksperimento ay isinagawa sa ilalim ng normal na mga kondisyon. Nangangahulugan ito na ang temperatura ay 273.15 Kelvin, ang presyon ay isang kapaligiran (760 millimeters ng mercury, o 101325 Pascals). Sa mga parameter na ito, ang gas ay sinakop ang dami na katumbas ng 22.4 litro. Samakatuwid, maaari nating sabihin na para sa isang nunal ng anumang gas, ang ratio ng mga numerical na parameter ay magiging pare-pareho ang halaga. Iyon ang dahilan kung bakit napagpasyahan na italaga ang figure na ito sa letrang R at tawagan itong universal gas constant. Kaya, ito ay katumbas ng 8.31. Ang unit ay J/molK.
Perpektong gas. Ang perpektong equation ng gas ng estado at ang pagmamanipula nito
Subukan nating muling isulat ang formula. Upang gawin ito, isinusulat namin ito sa form na ito: pV=RT. Susunod, nagsasagawa kami ng isang simpleng aksyon, i-multiply ang magkabilang panig ng equation sa pamamagitan ng isang di-makatwirang bilang ng mga moles. Nakukuha namin ang pVu=uRT. Isaalang-alang natin ang katotohanan na ang produkto ng dami ng molar atang dami ng bagay ay ang dami lang. Ngunit pagkatapos ng lahat, ang bilang ng mga moles ay magkasabay na katumbas ng quotient ng masa at ang molar mass. Ito ay eksakto kung ano ang hitsura ng Mendeleev-Clapeyron equation. Nagbibigay ito ng isang malinaw na ideya kung anong uri ng sistema ang nabuo ng isang perpektong gas. Ang equation ng estado para sa isang ideal na gas ay kukuha ng anyo: pV=mRT/M.
Deduce ang formula para sa pressure
Gumawa pa tayo ng ilang manipulasyon gamit ang mga nakuhang expression. Upang gawin ito, ang kanang bahagi ng equation ng Mendeleev-Clapeyron ay pinarami at hinahati sa numero ng Avogadro. Ngayon ay maingat nating tinitingnan ang produkto ng dami ng sangkap sa pamamagitan ng numero ng Avogadro. Ito ay walang iba kundi ang kabuuang bilang ng mga molekula sa gas. Ngunit sa parehong oras, ang ratio ng unibersal na pare-pareho ng gas sa numero ng Avogadro ay magiging katumbas ng Boltzmann constant. Samakatuwid, ang mga formula para sa presyon ay maaaring isulat bilang mga sumusunod: p=NkT/V o p=nkT. Dito ang simbolo n ay ang konsentrasyon ng butil.
Mga perpektong proseso ng gas
Sa molecular physics mayroong isang bagay tulad ng isoprocesses. Ito ang mga prosesong thermodynamic na nagaganap sa system sa isa sa mga pare-parehong parameter. Sa kasong ito, ang masa ng sangkap ay dapat ding manatiling pare-pareho. Tingnan natin ang mga ito nang mas partikular. Kaya, ang mga batas ng ideal na gas.
Nananatiling pare-pareho ang presyon
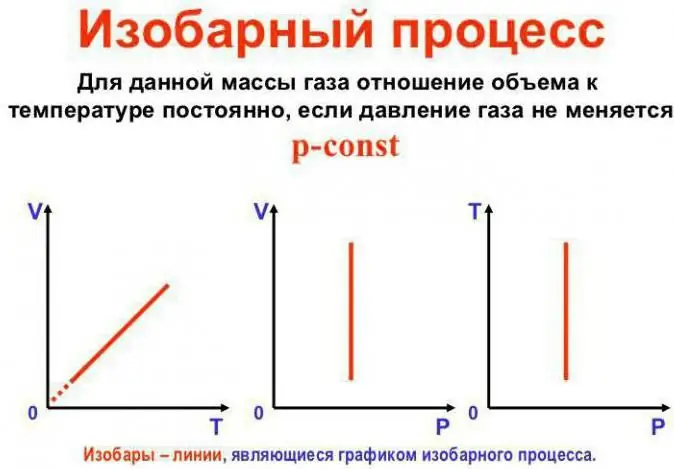
Ito ang batas ng Gay-Lussac. Mukhang ganito: V/T=const. Maaari itong muling isulat sa ibang paraan: V=Vo (1 + at). Dito ang a ay katumbas ng 1/273.15 K^-1 at tinatawag na "volume expansion coefficient". Maaari nating palitan ang temperatura sa parehong Celsius atang sukat ng Kelvin. Sa huling kaso, makukuha natin ang formula na V=Voat.
Nananatiling pare-pareho ang volume

Ito ang pangalawang batas ng Gay-Lussac, na mas karaniwang tinutukoy bilang batas ni Charles. Mukhang ganito: p/T=const. May isa pang pagbabalangkas: p=po (1 + at). Ang mga pagbabago ay maaaring isagawa alinsunod sa nakaraang halimbawa. Gaya ng nakikita mo, ang mga ideal na batas sa gas ay minsan ay halos magkapareho sa isa't isa.
Nananatiling pare-pareho ang temperatura

Kung mananatiling pare-pareho ang temperatura ng ideal na gas, makukuha natin ang batas ng Boyle-Mariotte. Maaari itong isulat ng ganito: pV=const.
Kaugnay na Konsepto 2: Bahagyang Presyon
Sabihin nating mayroon tayong sisidlan na may mga gas. Ito ay magiging isang timpla. Ang sistema ay nasa isang estado ng thermal equilibrium, at ang mga gas mismo ay hindi tumutugon sa isa't isa. Dito ang N ay magsasaad ng kabuuang bilang ng mga molekula. N1, N2 at iba pa, ayon sa pagkakabanggit, ang bilang ng mga molekula sa bawat isa sa mga bahagi ng pinaghalong. Kunin natin ang formula ng presyon p=nkT=NkT/V. Maaari itong buksan para sa isang partikular na kaso. Para sa isang pinaghalong dalawang bahagi, ang formula ay kukuha ng anyo: p=(N1 + N2) kT/V. Ngunit pagkatapos ay lumalabas na ang kabuuang presyon ay susumahin mula sa mga bahagyang presyon ng bawat timpla. Kaya, ito ay magmumukhang p1 + p2 at iba pa. Ito ang magiging bahagyang mga panggigipit.
Para saan ito?
Ang formula na aming nakuha ay nagpapahiwatig na ang presyon sa system ay mula sa bawat pangkat ng mga molekula. Nagkataon, hindi ito nakasalalay saiba pa. Sinamantala ito ni D alton nang bumalangkas ng batas, na kalaunan ay pinangalanan sa kanya: sa isang halo kung saan ang mga gas ay walang kemikal na reaksyon sa isa't isa, ang kabuuang presyon ay magiging katumbas ng kabuuan ng mga partial pressure.






