Ang pag-aaral sa mga prosesong nagaganap sa mga sistema ng istatistika ay kumplikado ng pinakamababang laki ng mga particle at ang kanilang malaking bilang. Halos imposibleng isaalang-alang ang bawat particle nang hiwalay, samakatuwid, ang mga istatistikal na dami ay ipinakilala: ang average na bilis ng mga particle, ang kanilang konsentrasyon, ang masa ng particle. Ang formula na nagpapakilala sa estado ng system, na isinasaalang-alang ang mga microscopic na parameter, ay tinatawag na pangunahing equation ng molecular-kinetic theory of gases (MKT).
Kaunti tungkol sa average na bilis ng particle
Ang pagtukoy sa bilis ng mga particle ay unang isinagawa sa eksperimento. Ang isang kilalang eksperimento mula sa kurikulum ng paaralan, na isinagawa ni Otto Stern, ay naging posible upang lumikha ng isang ideya ng mga bilis ng butil. Sa panahon ng eksperimento, pinag-aralan ang paggalaw ng mga silver na atom sa mga umiikot na cylinder: una, sa isang nakatigil na estado ng pag-install, pagkatapos ay kapag ito ay umikot sa isang tiyak na angular na bilis.
Bilang resulta, napag-alaman na ang bilis ng mga molekulang pilak ay lumampas sa bilis ng tunog at 500 m/s. Ang katotohanan ay medyo kawili-wili, dahil mahirap para sa isang tao na makaramdam ng ganoong bilis ng paggalaw ng mga particle sa mga sangkap.
Ideal na gas
Magpatuloy sa pagsasaliksikMukhang posible lamang sa isang sistema na ang mga parameter ay maaaring matukoy sa pamamagitan ng direktang mga sukat gamit ang mga pisikal na instrumento. Ang bilis ay sinusukat gamit ang isang speedometer, ngunit ang ideya ng paglakip ng isang speedometer sa isang particle ay walang katotohanan. Tanging isang macroscopic na parameter na nauugnay sa paggalaw ng particle ang maaaring direktang masukat.
Isaalang-alang ang presyon ng gas. Ang presyon sa mga dingding ng sisidlan ay nilikha ng mga epekto ng mga molekula ng gas sa sisidlan. Ang kakaiba ng gas na estado ng bagay ay nasa sapat na malalaking distansya sa pagitan ng mga particle at ang kanilang maliit na pakikipag-ugnayan sa isa't isa. Nagbibigay-daan ito sa iyong direktang sukatin ang presyon nito.
Anumang sistema ng mga nakikipag-ugnayang katawan ay nailalarawan sa pamamagitan ng potensyal na enerhiya at kinetic energy ng paggalaw. Ang tunay na gas ay isang kumplikadong sistema. Ang pagkakaiba-iba ng potensyal na enerhiya ay hindi nagbibigay ng sarili sa systematization. Ang problema ay maaaring malutas sa pamamagitan ng pagpapakilala ng isang modelo na nagdadala ng mga katangian ng gas, na tinatanggal ang pagiging kumplikado ng pakikipag-ugnayan.
Ang ideal na gas ay isang estado ng bagay kung saan ang interaksyon ng mga particle ay bale-wala, ang potensyal na enerhiya ng pakikipag-ugnayan ay nagiging zero. Tanging ang enerhiya ng paggalaw, na nakasalalay sa bilis ng mga particle, ang maaaring ituring na makabuluhan.
Ideal na presyon ng gas
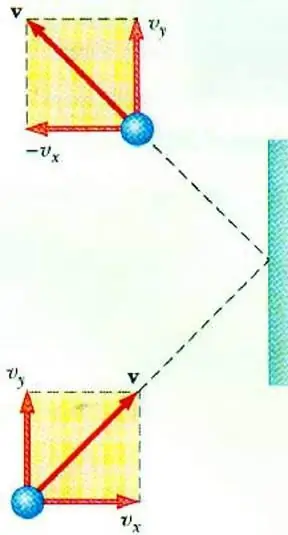
Upang ipakita ang kaugnayan sa pagitan ng presyon ng gas at ang bilis ng mga particle nito ay nagbibigay-daan sa pangunahing equation ng MKT ng isang perpektong gas. Ang isang butil na gumagalaw sa isang sisidlan, sa pagtama sa dingding, ay naglilipat dito ng isang salpok, ang halaga nito ay maaaring matukoy batay sa pangalawang batas. Newton:
F∆t=2m0vx
Ang pagbabago sa momentum ng isang particle sa panahon ng elastic impact ay nauugnay sa isang pagbabago sa pahalang na bahagi ng bilis nito. Ang F ay ang puwersang kumikilos mula sa gilid ng particle sa dingding sa loob ng maikling panahon t; m0 - masa ng butil.
Lahat ng gas particle ay bumabangga sa ibabaw ng lugar S sa oras na ∆t, gumagalaw sa direksyon ng surface na may bilis na vx at matatagpuan sa isang silindro na may volume na Sυ x Δt. Sa konsentrasyon ng butil n, eksaktong kalahati ng mga molekula ang gumagalaw patungo sa dingding, ang kalahati naman ay gumagalaw sa kabilang direksyon.
Pagkatapos isaalang-alang ang banggaan ng lahat ng mga particle, maaari nating isulat ang batas ni Newton para sa puwersang kumikilos sa lugar:
F∆t=nm0vx2S∆t
Dahil ang presyon ng gas ay tinukoy bilang ang ratio ng puwersa na kumikilos patayo sa ibabaw sa lugar ng huli, maaari nating isulat ang:
p=F: S=nm0vx2
Ang resultang kaugnayan bilang pangunahing equation ng MKT ay hindi mailalarawan ang buong sistema, dahil isang direksyon lang ng paggalaw ang isinasaalang-alang.
Pamamahagi ng Maxwell
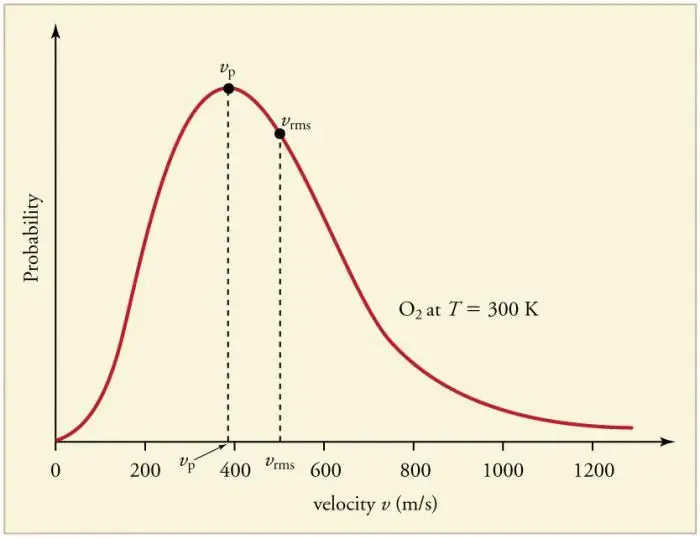
Ang patuloy na madalas na banggaan ng mga particle ng gas sa mga dingding at sa isa't isa ay humahantong sa pagtatatag ng isang tiyak na istatistikal na pamamahagi ng mga particle sa mga tuntunin ng mga bilis (enerhiya). Ang mga direksyon ng lahat ng velocity vector ay pantay na posibilidad. Ang pamamahagi na ito ay tinatawag na pamamahagi ng Maxwell. Noong 1860 ang pattern na ito ayhinango ni J. Maxwell sa batayan ng MKT. Ang mga pangunahing parameter ng batas sa pamamahagi ay tinatawag na mga bilis: malamang, naaayon sa maximum na halaga ng curve, at root-mean-square vkv=√‹v2 › - ang ibig sabihin ng parisukat ng bilis ng particle.
Ang pagtaas ng temperatura ng gas ay tumutugma sa pagtaas ng bilis.
Batay sa katotohanan na ang lahat ng bilis ay pantay, at ang kanilang mga module ay may parehong halaga, maaari nating ipagpalagay na:
‹v2›=‹vx2› + ‹v y2› + ‹vz2›, mula sa: ‹ vx2›=‹v2›: 3
Ang pangunahing equation ng MKT, na isinasaalang-alang ang average na halaga ng presyon ng gas, ay:
p=nm0‹v2›: 3.
Natatangi ang relasyong ito dahil tinutukoy nito ang kaugnayan sa pagitan ng mga microscopic na parameter: bilis, particle mass, particle concentration at gas pressure sa pangkalahatan.
Gamit ang konsepto ng kinetic energy ng mga particle, ang pangunahing equation ng MKT ay maaaring muling isulat sa ibang paraan:
p=2nm0‹v2›: 6=2n‹Ek›: 3
Ang presyon ng isang gas ay proporsyonal sa average na halaga ng kinetic energy ng mga particle nito.
Temperature
Kawili-wili, para sa patuloy na dami ng gas sa isang saradong sisidlan, maiuugnay ng isa ang presyon ng gas at ang average na halaga ng enerhiya ng paggalaw ng particle. Sa kasong ito, ang presyon ay maaaring masukat sa pamamagitan ng pagsukat ng enerhiyamga particle.
Ano ang gagawin? Anong halaga ang maihahambing sa kinetic energy? Ang temperatura ay lumalabas na isang halaga.

Ang temperatura ay isang sukatan ng thermal state ng mga substance. Upang sukatin ito, ginagamit ang isang thermometer, ang batayan nito ay ang thermal expansion ng working fluid (alkohol, mercury) kapag pinainit. Ang sukatan ng thermometer ay ginawang eksperimento. Karaniwan, ang mga marka ay inilalagay dito na naaayon sa posisyon ng gumaganang likido sa panahon ng ilang pisikal na proseso na nagaganap sa isang pare-parehong thermal state (tubig na kumukulo, natutunaw na yelo). Ang iba't ibang mga thermometer ay may iba't ibang mga kaliskis. Halimbawa, Celsius, Fahrenheit.

Pangkalahatang sukat ng temperatura
Ang mga thermometer ng gas ay maaaring ituring na mas kawili-wili sa mga tuntunin ng pagsasarili mula sa mga katangian ng gumaganang likido. Ang kanilang sukat ay hindi nakasalalay sa uri ng gas na ginamit. Sa ganoong aparato, maaaring iisa-isa ng isa ang temperatura kung saan ang presyon ng gas ay nagiging zero. Ipinapakita ng mga kalkulasyon na tumutugma ang value na ito sa -273.15 oC. Ang sukat ng temperatura (absolute temperature scale o Kelvin scale) ay ipinakilala noong 1848. Ang posibleng temperatura ng zero na presyon ng gas ay kinuha bilang pangunahing punto ng sukat na ito. Ang isang unit segment ng scale ay katumbas ng isang unit value ng Celsius scale. Mukhang mas maginhawang isulat ang pangunahing equation ng MKT gamit ang temperatura kapag pinag-aaralan ang mga proseso ng gas.
Kaugnayan sa pagitan ng presyon at temperatura
Empirically, maaari mong i-verify iyonproporsyonalidad ng presyon ng gas sa temperatura nito. Kasabay nito, natagpuan na ang presyon ay direktang proporsyonal sa konsentrasyon ng mga particle:
P=nkT,
kung saan ang T ay ganap na temperatura, ang k ay pare-parehong katumbas ng 1.38•10-23J/K.
Ang pangunahing halaga, na may pare-parehong halaga para sa lahat ng gas, ay tinatawag na Boltzmann constant.
Paghahambing ng pag-asa ng presyon sa temperatura at ang pangunahing equation ng mga MKT gas, maaari nating isulat:
‹Ek›=3kT: 2
Ang average na halaga ng kinetic energy ng paggalaw ng mga molekula ng gas ay proporsyonal sa temperatura nito. Ibig sabihin, ang temperatura ay maaaring magsilbing sukatan ng kinetic energy ng particle motion.






