Sa thermodynamics, kapag nag-aaral ng mga transition mula sa inisyal hanggang sa huling estado ng isang system, mahalagang malaman ang thermal effect ng proseso. Ang konsepto ng kapasidad ng init ay malapit na nauugnay sa epekto na ito. Sa artikulong ito, isasaalang-alang natin ang tanong kung ano ang ibig sabihin ng isochoric heat capacity ng isang gas.
Ideal na gas
Ang perpektong gas ay isang gas na ang mga particle ay itinuturing na mga materyal na punto, ibig sabihin, wala silang mga sukat, ngunit may masa, at kung saan ang lahat ng panloob na enerhiya ay binubuo lamang ng kinetic energy ng paggalaw ng mga molekula at atoms.
Anumang tunay na gas ay hindi kailanman makakatugon sa inilarawang modelo, dahil ang mga particle nito ay mayroon pa ring ilang linear na dimensyon at nakikipag-ugnayan sa isa't isa gamit ang mahihinang van der Waals bond o mga kemikal na bono ng ibang uri. Gayunpaman, sa mababang presyon at mataas na temperatura, ang mga distansya sa pagitan ng mga molekula ay malaki, at ang kanilang kinetic energy ay lumampas sa potensyal na enerhiya ng dose-dosenang beses. Ginagawa nitong posible na ilapat nang may mataas na antas ng katumpakan ang perpektong modelo para sa mga totoong gas.
Internal na enerhiya ng gas
Ang panloob na enerhiya ng anumang sistema ay isang pisikal na katangian, na katumbas ng kabuuan ng potensyal at kinetic na enerhiya. Dahil ang potensyal na enerhiya ay maaaring mapabayaan sa mga ideal na gas, maaari nating isulat ang pagkakapantay-pantay para sa kanila:
U=Ek.
Kung saan ang Ek ay ang enerhiya ng kinetic system. Gamit ang molecular kinetic theory at paglalapat ng unibersal na Clapeyron-Mendeleev equation ng estado, hindi mahirap makakuha ng expression para sa U. Ito ay nakasulat sa ibaba:
U=z/2nRT.
Dito ang T, R at n ay ang absolute temperature, ang gas constant at ang dami ng substance, ayon sa pagkakabanggit. Ang z-value ay isang integer na nagsasaad ng bilang ng mga degree ng kalayaan na mayroon ang isang molekula ng gas.
Isobaric at isochoric heat capacity
Sa physics, ang heat capacity ay ang dami ng init na dapat ibigay sa system na pinag-aaralan upang mapainit ito ng isang kelvin. Totoo rin ang reverse definition, ibig sabihin, ang heat capacity ay ang dami ng init na inilalabas ng system kapag pinalamig ng isang kelvin.
Ang pinakamadaling paraan para sa isang system ay upang matukoy ang isochoric heat capacity. Ito ay nauunawaan bilang ang kapasidad ng init sa pare-pareho ang dami. Dahil ang sistema ay hindi gumaganap ng trabaho sa ilalim ng ganitong mga kondisyon, ang lahat ng enerhiya ay ginugol sa pagtaas ng panloob na reserbang enerhiya. Tukuyin natin ang isochoric heat capacity sa pamamagitan ng simbolong CV, pagkatapos ay maaari nating isulat ang:
dU=CVdT.
Ibig sabihin, ang pagbabago sa panloob na enerhiyaAng sistema ay direktang proporsyonal sa pagbabago ng temperatura nito. Kung ihahambing natin ang expression na ito sa pagkakapantay-pantay na nakasulat sa nakaraang talata, darating tayo sa formula para sa CV sa isang ideal na gas:
СV=z/2nR.
Ang halagang ito ay hindi maginhawang gamitin sa pagsasanay, dahil nakadepende ito sa dami ng substance sa system. Samakatuwid, ang konsepto ng tiyak na isochoric na kapasidad ng init ay ipinakilala, iyon ay, isang halaga na kinakalkula alinman sa bawat 1 mol ng gas o bawat 1 kg. Tukuyin natin ang unang halaga sa pamamagitan ng simbolong CV, ang pangalawa - sa pamamagitan ng simbolong CV m. Para sa kanila, maaari mong isulat ang mga sumusunod na formula:
CV=z/2R;
CVm=z/2R/M.
Narito ang M ang molar mass.
Ang
Isobaric ay ang kapasidad ng init habang pinapanatili ang pare-parehong presyon sa system. Ang isang halimbawa ng naturang proseso ay ang pagpapalawak ng gas sa isang silindro sa ilalim ng piston kapag ito ay pinainit. Hindi tulad ng isochoric na proseso, sa panahon ng isobaric na proseso, ang init na ibinibigay sa system ay ginugugol upang madagdagan ang panloob na enerhiya at upang magsagawa ng mekanikal na gawain, iyon ay:
H=dU + PdV.
Ang enthalpy ng isang isobaric na proseso ay ang produkto ng isobaric heat capacity at ang pagbabago sa temperatura sa system, iyon ay:
H=CPdT.
Kung isasaalang-alang natin ang pagpapalawak sa pare-parehong presyon ng 1 mole ng gas, ang unang batas ng thermodynamics ay isusulat bilang:
CPdT=CV dT + RdT.
Ang huling termino ay nakuha mula sa equationClapeyron-Mendeleev. Mula sa pagkakapantay-pantay na ito ay sumusunod ang kaugnayan sa pagitan ng isobaric at isochoric na kapasidad ng init:
CP=CV + R.
Para sa perpektong gas, ang tiyak na kapasidad ng init ng molar sa pare-parehong presyon ay palaging mas malaki kaysa sa katumbas na isochoric na katangian ng R=8, 314 J/(molK).
Mga antas ng kalayaan ng mga molekula at kapasidad ng init
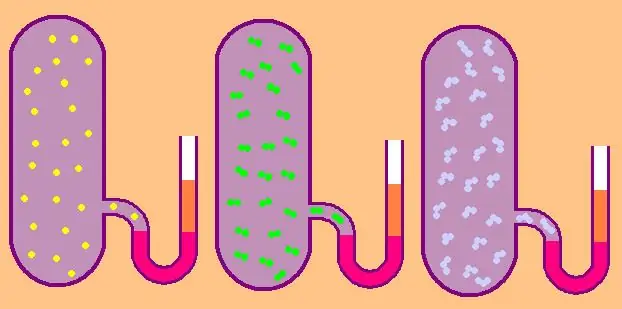
Isulat nating muli ang formula para sa partikular na molar isochoric heat capacity:
CV=z/2R.
Sa kaso ng monatomic gas, ang value na z=3, dahil ang mga atom sa kalawakan ay maaari lamang gumalaw sa tatlong independiyenteng direksyon.
Kung pinag-uusapan natin ang tungkol sa isang gas na binubuo ng mga diatomic molecule, halimbawa, oxygen O2 o hydrogen H2, kung gayon, bilang karagdagan sa translational motion, ang mga molekula na ito ay maaari pa ring umikot sa dalawang magkaparehong patayong axes, ibig sabihin, ang z ay magiging katumbas ng 5.
Para sa mas kumplikadong mga molekula, gamitin ang z=6. upang matukoy ang CV






