Sa ating panahon, ang pisika ay naging isang pangkaraniwang agham. Ito ay literal na naroroon sa lahat ng dako. Ang pinakapangunahing halimbawa: ang isang puno ng mansanas ay lumalaki sa iyong bakuran, at ang mga prutas ay hinog dito, ang oras ay darating at ang mga mansanas ay nagsisimulang mahulog, ngunit sa anong direksyon sila nahuhulog? Salamat sa batas ng unibersal na grabitasyon, ang ating fetus ay bumagsak sa lupa, iyon ay, bumaba ito, ngunit hindi tumaas. Isa ito sa mga pinakatanyag na halimbawa ng physics, ngunit bigyang-pansin natin ang thermodynamics, o mas tiyak, sa phase equilibria, na hindi gaanong mahalaga sa ating buhay.
Thermodynamics

Una sa lahat, tingnan natin ang terminong ito. ΘερΜοδυναΜική - ganito ang hitsura ng salita sa Greek. Ang unang bahagi na ΘερΜo ay nangangahulugang "init", at ang pangalawang δυναΜική ay nangangahulugang "lakas". Ang Thermodynamics ay isang sangay ng physics na nag-aaral ng mga katangian ng isang macroscopic system, pati na rin ang iba't ibang paraan ng pag-convert at paglilipat ng enerhiya. Sa seksyong ito, ang iba't ibang mga estado at proseso ay espesyal na pinag-aralan upang ang konsepto ng temperatura ay maipasok sa paglalarawan (ito ay isang pisikal na dami na nagpapakilala sa isang thermodynamic system at sinusukat gamit angilang mga kagamitan). Ang lahat ng patuloy na proseso sa mga thermodynamic system ay inilalarawan lamang ng mga microscopic na dami (presyon at temperatura, pati na rin ang konsentrasyon ng mga bahagi).
Clapeyron-Clausius equation
Alam ng bawat physicist ang equation na ito, ngunit hatiin natin ito nang paisa-isa. Ito ay tumutukoy sa mga proseso ng ekwilibriyo ng paglipat ng ilang bagay mula sa isang yugto patungo sa isa pa. Ito ay malinaw na nakikita sa mga ganitong halimbawa: pagtunaw, pagsingaw, sublimation (isa sa mga paraan upang mapanatili ang mga produkto, na nagaganap sa pamamagitan ng ganap na pag-alis ng kahalumigmigan). Malinaw na ipinapakita ng formula ang mga kasalukuyang proseso:
- n=PV/RT;
- kung saan ang T ay ang temperatura ng substance;
- P-pressure;
- R-specific na init ng phase transition;
- V-pagbabago sa partikular na volume.
Ang kasaysayan ng paglikha ng equation

Ang Clausius-Clapeyron equation ay isang mahusay na paliwanag sa matematika ng pangalawang batas ng thermodynamics. Tinutukoy din bilang "Clausius inequality". Naturally, ang teorama ay binuo ng siyentipiko mismo, na gustong ipaliwanag ang kaugnayan sa pagitan ng daloy ng init sa system at entropy, pati na rin ang kapaligiran nito. Ang equation na ito ay binuo ni Clausius sa kanyang mga pagtatangka na ipaliwanag at i-quantify ang entropy. Sa literal na kahulugan, ang theorem ay nagbibigay sa atin ng pagkakataong matukoy kung ang isang paikot na proseso ay mababaligtad o hindi maibabalik. Ang hindi pagkakapantay-pantay na ito ay nag-aalok sa atin ng quantitative formula para sa pag-unawa sa pangalawang batas.
Ang scientist ay isa sa mga unang gumawa sa ideya ng entropy, at nagbigay pa nitopangalan ng proseso. Ang kilala ngayon bilang theorem ni Clausius ay unang inilathala noong 1862 sa ikaanim na gawa ni Rudolf, On the Use of the Transformation Equivalence Theorem for Interior Work. Sinubukan ng siyentipiko na magpakita ng proporsyonal na relasyon sa pagitan ng entropy at daloy ng enerhiya sa pamamagitan ng pag-init (δ Q) sa system. Sa konstruksiyon, ang thermal energy na ito ay maaaring ma-convert sa trabaho, at maaari itong mabago sa init sa pamamagitan ng isang cyclic na proseso. Pinatunayan ni Rudolph na "ang algebraic na kabuuan ng lahat ng pagbabagong nagaganap sa isang paikot na proseso ay maaari lamang mas mababa sa zero o, sa matinding mga kaso, katumbas ng zero."
Closed isolated system
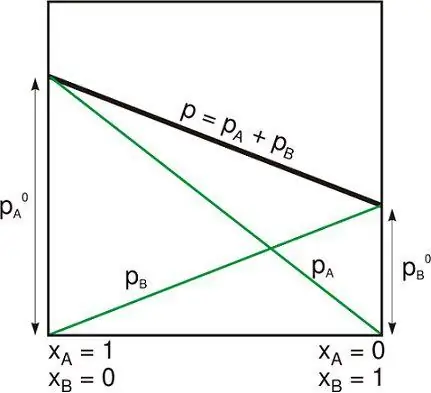
Isolated system ay isa sa mga sumusunod:
- Malayo ang pisikal na sistema sa iba na hindi nakikipag-ugnayan sa kanila.
- Ang thermodynamic system ay sarado sa pamamagitan ng matibay na hindi magagalaw na pader kung saan hindi madadaanan ang alinman sa bagay o enerhiya.
Sa kabila ng katotohanan na ang paksa ay panloob na nauugnay sa sarili nitong gravity, ang isang nakahiwalay na sistema ay karaniwang kinukuha nang lampas sa mga limitasyon ng panlabas na gravitational at iba pang malalayong pwersa.
Ito ay maaaring ihambing sa kung ano (sa mas pangkalahatang terminolohiya na ginagamit sa thermodynamics) ay tinatawag na isang saradong sistema na napapalibutan ng mga piling pader kung saan ang enerhiya ay maaaring ilipat sa anyo ng init o trabaho, ngunit hindi bagay. At sa isang bukas na sistema kung saan ang bagay at enerhiya ay pumapasok o lumalabas, bagaman ito ay maaaring may iba't ibang hindi maarok na mga pader sabahagi ng mga hangganan nito.
Isolated system ang sumusunod sa conservation law. Kadalasan sa thermodynamics, ang matter at energy ay itinuturing na magkahiwalay na konsepto.
Thermodynamic transition
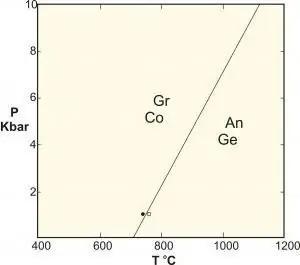
Upang maunawaan ang mga quantum phase transition, kapaki-pakinabang na ihambing ang mga ito sa mga klasikal na pagbabagong-anyo (tinatawag ding thermal inversions). Inilalarawan ng CPT ang cusp sa mga thermodynamic na katangian ng isang system. Ito ay nagpapahiwatig ng muling pagsasaayos ng mga particle. Ang isang tipikal na halimbawa ay ang nagyeyelong paglipat ng tubig, na naglalarawan ng isang maayos na paglipat sa pagitan ng isang likido at isang solid. Ang mga classical phase growth ay dahil sa kompetisyon sa pagitan ng energy ng system at ng entropy ng thermal fluctuations nito.
Ang isang klasikal na sistema ay walang entropy sa zero na temperatura at samakatuwid ay walang phase transformation na maaaring mangyari. Ang kanilang pagkakasunud-sunod ay tinutukoy ng unang discontinuous derivative thermodynamic potential. At, siyempre, mayroon itong unang order. Ang mga pagbabagong yugto mula sa isang ferromagnet patungo sa isang paramagnet ay tuloy-tuloy at pangalawang pagkakasunud-sunod. Ang mga patuloy na pagbabagong ito mula sa isang ordered sa isang disordered phase ay inilalarawan ng isang order parameter na zero. Para sa ferromagnetic transformation sa itaas, ang parameter ng order ay ang kabuuang magnetization ng system.
Gibbs potential
Ang Gibbs Free Energy ay ang maximum na dami ng trabaho nang walang pagpapalawak na maaaring alisin mula sa isang thermodynamic closed system (na maaaring makipagpalitan ng init at gumana sa kapaligiran). ganyanang pinakamataas na resulta ay maaaring makuha lamang sa isang ganap na nababaligtad na proseso. Kapag bumalik ang system mula sa unang estado patungo sa pangalawa, ang pagbawas sa libreng enerhiya ng Gibbs ay katumbas ng ginawa ng system sa kapaligiran nito, na binawasan ang gawain ng mga puwersa ng presyon.
States of balance

Ang Thermodynamic at mechanical equilibrium ay isang axiomatic na konsepto ng thermodynamics. Ito ang panloob na estado ng isa o higit pang mga sistema na konektado ng higit pa o hindi gaanong natatagusan o hindi natatagusan na mga pader. Sa ganitong estado, walang mga purong macroscopic na daloy ng matter o enerhiya, sa loob ng isang system o sa pagitan ng mga system.
Sa sarili nitong kuru-kuro ng estado ng panloob na ekwilibriyo, hindi nagaganap ang macroscopic na pagbabago. Ang mga sistema ay sabay-sabay sa mutual thermal, mechanical, chemical (constant), radiation equilibria. Maaaring sila ay nasa parehong anyo. Sa prosesong ito, ang lahat ng view ay nai-save nang sabay-sabay at walang katiyakan hanggang sa masira ang pisikal na operasyon. Sa macroscopic equilibrium, ganap na tumpak na balanseng palitan ang magaganap. Ang patunay sa itaas ay isang pisikal na paliwanag ng konseptong ito.
Basics
Ang bawat batas, theorems, formula ay may kanya-kanyang pundasyon. Tingnan natin ang 3 pundasyon ng batas ng phase equilibrium.
- Ang Phase ay isang anyo ng matter, homogenous sa kemikal na komposisyon, pisikal na estado at mekanikal na balanse. Ang mga karaniwang yugto ay solid, likido at gas. Ang dalawang hindi mapaghalo na likido (o mga likidong pinaghalong may magkakaibang komposisyon) na pinaghihiwalay ng magkahiwalay na hangganan ay itinuturing na dalawang magkaibang mga phase at hindi mapaghalo na mga solid.
- Ang bilang ng mga bahagi (C) ay ang bilang ng mga sangkap na independyente sa kemikal ng system. Ang minimum na bilang ng mga independiyenteng species na kinakailangan upang matukoy ang komposisyon ng lahat ng mga yugto ng system.
- Ang bilang ng mga antas ng kalayaan (F) sa kontekstong ito ay ang bilang ng mga masinsinang variable na independyente sa isa't isa.
Pag-uuri ayon sa phase equilibria
- Ang mga reaksyon ng tuluy-tuloy na net transfer (madalas na tinatawag na solid state reaction) ay nagaganap sa pagitan ng solid matter ng iba't ibang komposisyon. Maaaring kabilang sa mga ito ang mga elementong matatagpuan sa mga likido (H, C), ngunit ang mga elementong ito ay pinananatili sa mga solidong bahagi, kaya walang mga bahagi ng likido na kasangkot bilang mga reactant o produkto (H2O, CO2). Ang solid pure transfer reactions ay maaaring tuloy-tuloy o hindi tuloy-tuloy, o terminal.
- Ang Polymorphic ay isang espesyal na uri ng solid phase reaction na kinabibilangan ng mga phase ng magkaparehong komposisyon. Ang mga klasikal na halimbawa ay ang mga reaksyon sa pagitan ng aluminum silicates kyanite-sillimanite-andalusite, ang conversion ng graphite sa brilyante sa mataas na presyon, at ang equilibrium ng calcium carbonate.
Mga batas ng ekwilibriyo

Ang Gibbs Factory Rule ay iminungkahi ni Josiah Willard Gibbs sa kanyang tanyag na papel na pinamagatang "The Equilibrium of Heterogenous Substances", na lumabas mula 1875 hanggang 1878. Nalalapat ito sanon-reactive multicomponent heterogenous system sa thermodynamic equilibrium at isang ibinigay na pagkakapantay-pantay:
- F=C-P+2;
- kung saan ang F ay ang bilang ng mga antas ng kalayaan;
- C - bilang ng mga bahagi;
- P - bilang ng mga phase sa thermodynamic equilibrium sa isa't isa.
Ang bilang ng mga antas ng kalayaan ay ang bilang ng mga hindi inookupahang intensive variable. Ang pinakamalaking bilang ng mga thermodynamic na parameter, tulad ng temperatura o presyon, na maaaring mag-iba nang sabay-sabay at arbitraryo nang hindi naaapektuhan ang isa't isa. Ang isang halimbawa ng isang isang bahagi na sistema ay ang isa na may isang purong kemikal, habang ang dalawang bahagi na sistema, tulad ng mga pinaghalong tubig at ethanol, ay may dalawang independiyenteng bahagi. Ang mga karaniwang phase transition (phase equilibrium) ay mga solid, likido, gas.
Phase rule sa pare-parehong presyon
Para sa mga aplikasyon sa agham ng mga materyales na tumatalakay sa mga pagbabago sa yugto sa pagitan ng iba't ibang solidong istruktura, madalas na nangyayari ang pare-parehong presyon (hal. isang kapaligiran) at hindi pinapansin bilang antas ng kalayaan, kaya ang panuntunan ay nagiging: F=C - P + 1.
Ang formula na ito ay minsan ay ipinakilala sa ilalim ng pangalang "condensed phase rule", ngunit tulad ng alam natin, hindi ito naaangkop sa mga system na ito na napapailalim sa mataas na presyon (halimbawa, sa geology), dahil ang mga kahihinatnan ng mga ito ang mga panggigipit ay maaaring magdulot ng mga sakuna na kahihinatnan.
Maaaring mukhang ang phase equilibrium ay isang walang laman na parirala, at may ilang mga pisikal na proseso kung saan ang sandaling itoay kasangkot, ngunit, tulad ng nakita natin, kung wala ito, marami sa mga batas na alam natin ay hindi gumagana, kaya kailangan mong medyo pamilyar sa mga kakaiba, makulay na ito, kahit na medyo nakakainip na mga panuntunan. Ang kaalamang ito ay nakatulong sa maraming tao. Natutunan nila kung paano ilapat ang mga ito sa kanilang sarili, halimbawa, ang mga electrician, na alam ang mga patakaran para sa pagtatrabaho sa mga phase, ay maaaring maprotektahan ang kanilang sarili mula sa hindi kinakailangang panganib.






