Kapag pinag-aaralan ang pag-uugali ng mga gas sa pisika, binibigyang pansin ang mga isoprocess, iyon ay, ang mga naturang transisyon sa pagitan ng mga estado ng system, kung saan ang isang thermodynamic parameter ay napanatili. Gayunpaman, mayroong isang paglipat ng gas sa pagitan ng mga estado, na hindi isang isoprocess, ngunit gumaganap ng isang mahalagang papel sa kalikasan at teknolohiya. Ito ay isang adiabatic na proseso. Sa artikulong ito, isasaalang-alang namin ito nang mas detalyado, na tumutuon sa kung ano ang gas adiabatic exponent.
Adiabatic na proseso
Ayon sa termodinamikong kahulugan, ang isang prosesong adiabatic ay nauunawaan bilang isang transisyon sa pagitan ng inisyal at panghuling estado ng system, bilang resulta kung saan walang pagpapalitan ng init sa pagitan ng panlabas na kapaligiran at ng sistemang pinag-aaralan. Posible ang ganitong proseso sa ilalim ng sumusunod na dalawang kundisyon:
- thermal conductivity sa pagitan ng panlabas na kapaligiran atmababa ang system para sa isang kadahilanan o iba pa;
- ang bilis ng proseso ay mataas, kaya ang init exchange ay walang oras na mangyari.
Sa engineering, ang adiabatic transition ay parehong ginagamit upang painitin ang gas sa panahon ng matalim na compression nito, at para palamig ito sa panahon ng mabilis na paglawak. Sa likas na katangian, ang pinag-uusapang termodinamikong transisyon ay nagpapakita ng sarili kapag tumaas o bumaba ang masa ng hangin sa gilid ng burol. Ang ganitong mga pagtaas at pagbaba ay humahantong sa pagbabago sa punto ng hamog sa hangin at pag-ulan.
Poisson's equation para sa adiabatic ideal gas

Ang perpektong gas ay isang sistema kung saan ang mga particle ay random na gumagalaw sa mataas na bilis, hindi nakikipag-ugnayan sa isa't isa at walang sukat. Napakasimple ng naturang modelo sa mga tuntunin ng paglalarawan nito sa matematika.
Ayon sa kahulugan ng proseso ng adiabatic, ang sumusunod na expression ay maaaring isulat alinsunod sa unang batas ng thermodynamics:
dU=-PdV.
Sa madaling salita, ang isang gas, lumalawak o kumukurot, ay gumagana ng PdV dahil sa katumbas na pagbabago sa panloob na enerhiya nito dU.
Sa kaso ng ideal na gas, kung gagamitin natin ang equation ng estado (Clapeyron-Mendeleev law), makukuha natin ang sumusunod na expression:
PVγ=const.
Ang pagkakapantay-pantay na ito ay tinatawag na Poisson equation. Ang mga taong pamilyar sa gas physics ay mapapansin na kung ang halaga ng γ ay katumbas ng 1, ang Poisson equation ay mapupunta sa Boyle-Mariotte law (isothermalproseso). Gayunpaman, ang gayong pagbabago ng mga equation ay imposible, dahil ang γ para sa anumang uri ng ideal na gas ay mas malaki kaysa sa isa. Ang dami ng γ (gamma) ay tinatawag na adiabatic index ng isang ideal na gas. Tingnan natin ang pisikal na kahulugan nito.
Ano ang adiabatic exponent?
Ang exponent γ, na lumalabas sa Poisson equation para sa isang ideal na gas, ay ang ratio ng kapasidad ng init sa pare-parehong presyon sa parehong halaga, ngunit nasa pare-parehong dami na. Sa pisika, ang kapasidad ng init ay ang dami ng init na dapat ilipat sa o kunin mula sa isang partikular na sistema upang mabago nito ang temperatura ng 1 Kelvin. Ipatukoy natin ang isobaric heat capacity sa pamamagitan ng simbolong CP, at ang isochoric heat capacity sa pamamagitan ng simbolo na CV. Pagkatapos ang pagkakapantay-pantay ay humahawak para sa γ:
γ=CP/CV.
Dahil ang γ ay palaging mas malaki kaysa sa isa, ipinapakita nito kung gaano karaming beses ang isobaric heat capacity ng pinag-aralan na gas system ay lumampas sa katulad na isochoric na katangian.
Mga kapasidad ng init ng CP at CV
Upang matukoy ang adiabatic exponent, dapat magkaroon ng isang mahusay na pag-unawa sa kahulugan ng mga dami CP at CV. Upang gawin ito, magsasagawa kami ng sumusunod na eksperimento sa pag-iisip: isipin na ang gas ay nasa saradong sistema sa isang sisidlan na may mga solidong pader. Kung ang sisidlan ay pinainit, kung gayon ang lahat ng ipinahayag na init ay perpektong mai-convert sa panloob na enerhiya ng gas. Sa ganoong sitwasyon, magiging wasto ang pagkakapantay-pantay:
dU=CVdT.
HalagaTinutukoy ng CVang dami ng init na dapat ilipat sa system upang isochorically init ito ng 1 K.
Ngayon ipagpalagay na ang gas ay nasa isang sisidlan na may gumagalaw na piston. Sa proseso ng pag-init ng naturang sistema, ang piston ay lilipat, na tinitiyak na ang isang pare-pareho ang presyon ay pinananatili. Dahil ang enthalpy ng system sa kasong ito ay magiging katumbas ng produkto ng isobaric heat capacity at ang pagbabago sa temperatura, ang unang batas ng thermodynamics ay magkakaroon ng anyo:
CPdT=CVdT + PdV.
Mula dito makikita na CP>CV, dahil sa kaso ng isobaric na pagbabago ng mga estado ay kinakailangan na gumastos ng init hindi lamang para tumaas ang temperatura ng system, at dahil dito ang panloob na enerhiya nito, kundi pati na rin ang gawaing ginagawa ng gas sa panahon ng pagpapalawak nito.
Ang halaga ng γ para sa perpektong monatomic gas
Ang pinakasimpleng sistema ng gas ay isang monatomic ideal na gas. Ipagpalagay na mayroon tayong 1 mole ng naturang gas. Alalahanin na sa proseso ng isobaric heating ng 1 mol ng gas sa pamamagitan lamang ng 1 Kelvin, ito ay gumagana na katumbas ng R. Ang simbolo na ito ay karaniwang ginagamit upang tukuyin ang unibersal na pare-pareho ng gas. Ito ay katumbas ng 8, 314 J / (molK). Kapag inilapat ang huling expression sa nakaraang talata para sa kasong ito, makukuha natin ang sumusunod na pagkakapantay-pantay:
CP=CV+ R.
Mula sa kung saan mo matutukoy ang halaga ng isochoric heat capacity CV:
γ=CP/CV;
CV=R/(γ-1).
Alam na para sa isang nunalmonatomic gas, ang halaga ng isochoric heat capacity ay:
CV=3/2R.
Mula sa huling dalawang pagkakapantay-pantay ay sumusunod sa halaga ng adiabatic exponent:
3/2R=R/(γ-1)=>
γ=5/3 ≈ 1, 67.
Tandaan na ang halaga ng γ ay nakasalalay lamang sa mga panloob na katangian ng gas mismo (sa polyatomic na katangian ng mga molekula nito) at hindi nakadepende sa dami ng sangkap sa system.
Pag-asa ng γ sa bilang ng mga antas ng kalayaan
Ang equation para sa isochoric heat capacity ng isang monatomic gas ay nakasulat sa itaas. Ang koepisyent na 3/2 na lumitaw dito ay nauugnay sa bilang ng mga antas ng kalayaan sa isang atom. Ito ay may kakayahang gumalaw lamang sa isa sa tatlong direksyon ng kalawakan, ibig sabihin, mayroon lamang mga translational degree ng kalayaan.
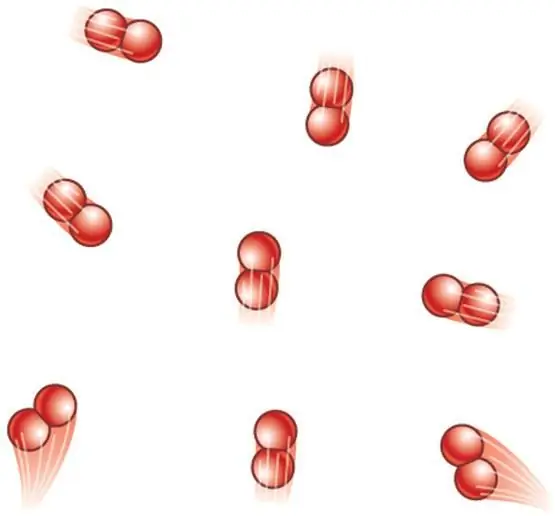
Kung ang sistema ay nabuo sa pamamagitan ng diatomic molecules, pagkatapos ay dalawa pang rotational degrees ang idaragdag sa tatlong translational na degree. Samakatuwid, ang expression para sa CV ay nagiging:
CV=5/2R.
Kung gayon ang halaga ng γ ay magiging:
γ=7/5=1, 4.
Tandaan na ang diatomic molecule ay may isa pang vibrational na antas ng kalayaan, ngunit sa mga temperatura na ilang daang Kelvin ay hindi ito naisaaktibo at hindi nakakatulong sa kapasidad ng init.
Kung ang mga molekula ng gas ay binubuo ng higit sa dalawang atom, magkakaroon sila ng 6 na antas ng kalayaan. Ang adiabatic exponent sa kasong ito ay magiging katumbas ng:
γ=4/3 ≈ 1, 33.
KayaKaya, habang ang bilang ng mga atomo sa isang molekula ng gas ay tumataas, ang halaga ng γ ay bumababa. Kung gagawa ka ng adiabatic graph sa mga P-V axes, mapapansin mo na ang curve para sa isang monatomic gas ay magiging mas matindi kaysa sa isang polyatomic.
Adiabatic exponent para sa pinaghalong mga gas
Ipinakita namin sa itaas na ang halaga ng γ ay hindi nakadepende sa kemikal na komposisyon ng sistema ng gas. Gayunpaman, depende ito sa bilang ng mga atomo na bumubuo sa mga molekula nito. Ipagpalagay natin na ang sistema ay binubuo ng N mga bahagi. Ang atomic fraction ng component i sa mixture ay ai. Pagkatapos, para matukoy ang adiabatic exponent ng mixture, maaari mong gamitin ang sumusunod na expression:
γ=∑i=1N(aiγ i).
Kung saan ang γi ay ang γ value para sa i-th component.
Halimbawa, ang expression na ito ay maaaring gamitin upang matukoy ang γ ng hangin. Dahil binubuo ito ng 99% diatomic molecules ng oxygen at nitrogen, ang adiabatic index nito ay dapat na napakalapit sa halagang 1.4, na kinumpirma ng eksperimental na pagpapasiya ng halagang ito.






