Ang pag-aaral ng mga katangian ng isang ideal na gas ay isang mahalagang paksa sa pisika. Ang pagpapakilala sa mga katangian ng mga sistema ng gas ay nagsisimula sa pagsasaalang-alang sa equation ng Boyle-Mariotte, dahil ito ang unang natuklasang eksperimental na batas ng isang perpektong gas. Isaalang-alang natin ito nang mas detalyado sa artikulo.
Ano ang ibig sabihin ng ideal gas?
Bago pag-usapan ang batas ng Boyle-Mariotte at ang equation na naglalarawan dito, tukuyin natin ang isang ideal na gas. Ito ay karaniwang nauunawaan bilang isang tuluy-tuloy na substance kung saan ang mga particle na bumubuo dito ay hindi nakikipag-ugnayan sa isa't isa, at ang kanilang mga sukat ay napakaliit kumpara sa average na interparticle na distansya.
Sa katunayan, ang anumang gas ay totoo, ibig sabihin, ang mga bumubuong atom at molekula nito ay may tiyak na sukat at hindi nakikipag-ugnayan sa isa't isa sa tulong ng mga puwersa ng van der Waals. Gayunpaman, sa mataas na ganap na temperatura (higit sa 300 K) at mababang presyon (mas mababa sa isang kapaligiran), ang kinetic energy ng mga atomo at molekula ay mas mataas kaysa sa enerhiya ng mga interaksyon ng van der Waals, kaya ang tunay na gas sa ipinahiwatigang mga kundisyong may mataas na katumpakan ay maaaring ituring na perpekto.
Boyle-Mariotte Equation
Mga katangian ng mga gas na aktibong ginalugad ng mga siyentipikong Europeo noong mga siglong XVII-XIX. Ang pinakaunang batas ng gas na natuklasan sa eksperimento ay ang batas na naglalarawan sa mga isothermal na proseso ng pagpapalawak at pag-compress ng isang sistema ng gas. Ang mga kaukulang eksperimento ay isinagawa ni Robert Boyle noong 1662 at Edm Mariotte noong 1676. Ang bawat isa sa mga siyentipikong ito ay nakapag-iisa na nagpakita na sa panahon ng isang isothermal na proseso sa isang saradong sistema ng gas, ang presyon ay nagbabago nang kabaligtaran sa dami. Ang eksperimentong nakuhang mathematical expression ng proseso ay nakasulat sa sumusunod na anyo:
PV=k
Kung saan ang P at V ay ang presyon sa system at ang volume nito, ang k ay ilang pare-pareho, ang halaga nito ay depende sa dami ng gas substance at temperatura nito. Kung bubuo ka ng dependence ng P(V) function sa isang graph, ito ay magiging hyperbola. Ang isang halimbawa ng mga curve na ito ay ipinapakita sa ibaba.
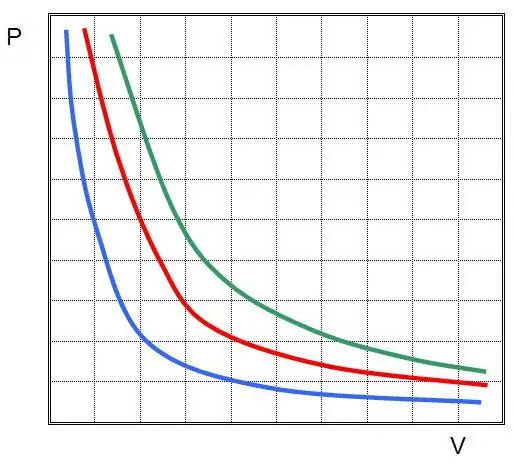
Ang nakasulat na pagkakapantay-pantay ay tinatawag na Boyle-Mariotte equation (batas). Ang batas na ito ay maaaring madaling mabalangkas tulad ng sumusunod: ang pagpapalawak ng isang perpektong gas sa isang pare-pareho ang temperatura ay humahantong sa isang proporsyonal na pagbaba ng presyon sa loob nito, sa kabaligtaran, ang isothermal compression ng isang sistema ng gas ay sinamahan ng isang proporsyonal na pagtaas ng presyon sa loob nito.
Ang perpektong equation ng gas
Ang
Boyle-Mariotte law ay isang espesyal na kaso ng isang mas pangkalahatang batas na nagtataglay ng mga pangalan ni Mendeleev atClapeyron. Si Emile Clapeyron, na nagbubuod sa pang-eksperimentong impormasyon sa pag-uugali ng mga gas sa ilalim ng iba't ibang panlabas na kondisyon, noong 1834 ay nakuha ang sumusunod na equation:
PV=nRT
Sa madaling salita, ang produkto ng volume V ng isang sistema ng gas at ang presyon P sa loob nito ay direktang proporsyonal sa produkto ng ganap na temperatura T at ang dami ng sangkap n. Ang koepisyent ng proporsyonalidad na ito ay tinutukoy ng letrang R at tinatawag na gas universal constant. Sa nakasulat na equation, ang halaga ng R ay lumitaw dahil sa pagpapalit ng isang bilang ng mga constant, na ginawa ni Dmitry Ivanovich Mendeleev noong 1874.
Mula sa unibersal na equation ng estado, madaling makita na ang constancy ng temperatura at ang dami ng substance ay ginagarantiyahan ang invariance ng kanang bahagi ng equation, na nangangahulugan na ang kaliwang bahagi ng equation ay mananatiling pare-pareho.. Sa kasong ito, makuha namin ang Boyle-Mariotte equation.

Iba pang batas sa gas
Ang Clapeyron-Mendeleev equation na nakasulat sa talata sa itaas ay naglalaman ng tatlong thermodynamic na parameter: P, V at T. Kung ang bawat isa sa kanila ay naayos, at ang dalawa pa ay pinapayagang magbago, pagkatapos ay makukuha natin ang Boyle-Mariotte, Charles at Gay-Lussac equation. Ang batas ni Charles ay nagsasalita ng isang direktang proporsyonalidad sa pagitan ng volume at temperatura para sa isang isobaric na proseso, at ang batas ni Gay-Lussac ay nagsasaad na sa kaso ng isang isochoric transition, ang presyon ng gas ay tumataas o bumaba sa direktang proporsyon sa ganap na temperatura. Ang mga katumbas na equation ay ganito ang hitsura:
V/T=const kapag P=const;
P/T=const kapag V=const.
KayaKaya, ang batas ni Boyle-Mariotte ay isa sa tatlong pangunahing batas sa gas. Gayunpaman, ito ay naiiba sa iba sa mga tuntunin ng graphic dependence: ang mga function na V(T) at P(T) ay mga tuwid na linya, ang function na P(V) ay isang hyperbola.
Halimbawa ng gawain para sa paglalapat ng batas ng Boyle-Mariotte
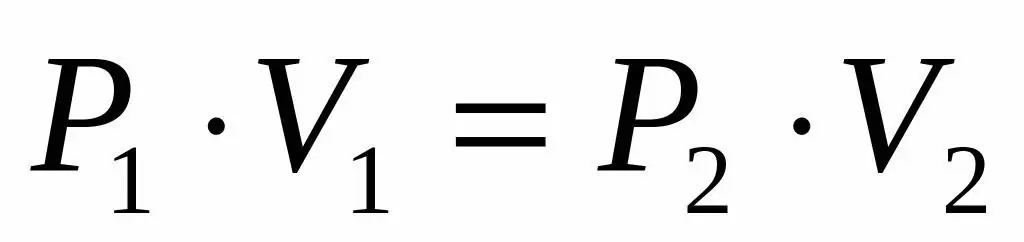
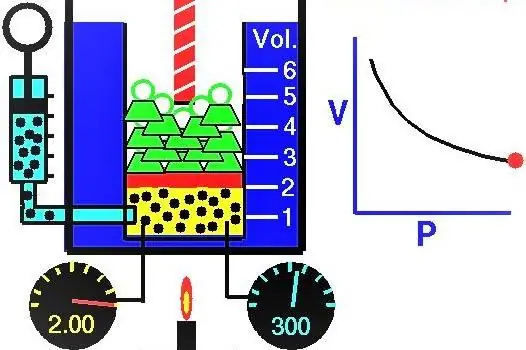
Ang dami ng gas sa silindro sa ilalim ng piston sa unang posisyon ay 2 litro, at ang presyon nito ay 1 atmospera. Ano ang presyon ng gas pagkatapos tumaas ang piston at ang dami ng sistema ng gas ay tumaas ng 0.5 litro. Ang proseso ay itinuturing na isothermal.
Dahil binibigyan tayo ng pressure at volume ng ideal gas, at alam din natin na hindi nagbabago ang temperatura sa panahon ng pagpapalawak nito, magagamit natin ang Boyle-Mariotte equation sa sumusunod na anyo:
P1V1=P2V 2
Ang pagkakapantay-pantay na ito ay nagsasabi na ang volume-pressure product ay pare-pareho para sa bawat estado ng gas sa isang partikular na temperatura. Sa pagpapahayag ng halagang P2 mula sa pagkakapantay-pantay, makuha namin ang panghuling formula:
P2=P1V1/V 2
Kapag gumagawa ng mga kalkulasyon ng presyon, maaari kang gumamit ng mga off-system unit sa kasong ito, dahil ang mga litro ay liliit, at makukuha natin ang pressure na P2sa mga atmospheres. Ang pagpapalit ng data mula sa kundisyon, dumating tayo sa sagot sa tanong ng problema: P2=0.8 atmospheres.






